CANNABIS ( Botanica )
Le piante di cannabis sono considerate come parte di un solo genere, Cannabis, famiglia, Cannabacee, ordine Urticali (1)
In base alle variazioni genetiche, da gran parte dei ricercatori, è stato proposto un genere con almeno due specie putative, Cannabis Sativa e Cannabis Indica (2, 3). Ad oggi sono stati identificati nella cannabis più di 104 diversi cannabinoidi (4). Altri composti identificati sono terpenoidi, flavonoidi, composti azotati e altre molecole comuni ad altre piante (5). Tra i cannabinoidi, la sostanza psicoattiva per eccellenza è il delta-9-tetraidrocannabinolo (THC), responsabile dello stato di dipendenza dei consumatori ricreazionali di cannabis, grazie alla sua capacità di agire come parziale agonista dei recettori cannabinoidi tipo 1 (CB1)(6-8). Il THC è sintetizzato nell’ambito dei tricomi, pori ghiandolari contenuti nei fiori, foglie e brattée ( foglie ridotte a protezione del bocciolo ) della pianta femmina (9).
Le piante di cannabis tipicamente esibiscono uno dei tre diversi fenotipi basati sulle concentrazioni assolute e relative di THC e cannabidiolo (CBD), che danno la possibilità di distinguere tra il tipo delta-9-THC, o tipo additogeno, il tipo intermedio, e il tipo CBD, ovvero piante di cannabis cresciute per la fibra (canapa industriale) o per estrazione di olio di semi in cui predomina la quota di CBD, mentre la quota di THC non eccede lo 0.7% del peso secco (9, 10,11).
Tabella. Fenotipo della cannabis
|
Fenotipo |
D9 THC |
CBD |
CBD/THC rapporto |
|
THC |
O,5 – 15% |
0,01 – 0,16% |
< 0,02 |
|
Ibrido |
0,5 – 5% |
0,9 – 7,3% |
0,6 – 4 |
|
CBD |
0,05 – 0,7% |
1,0 – 13,6% |
> 5 |
Da: National Accademies of Sciences, Engineering and Medicine. The health effects of cannabis and cannabinoids: the current state of evidence and recommendations for research. National Accademies Press, 2017 (9)
Bibliografia
(1). Kuddus, M., Ginawi, I. A., & Al-Hazimi, A. (2013). Cannabis sativa: An ancient wild edible plant of India. Emirates Journal of Food and Agriculture, 736-745.
(2) Clarke, R. C., & Merlin, M. D. (2015). Letter to the Editor: Small, Ernest. 2015. Evolution and Classification of Cannabis sativa (Marijuana, Hemp) in Relation to Human Utilization. Botanical Review 81 (3): 189-294. The Botanical Review, 81(4), 295-305.
(3) Hillig, K. W. (2005). Genetic evidence for speciation in Cannabis (Cannabaceae). Genetic Resources and Crop Evolution, 52(2), 161-180.
(4) ElSohly, M. A. (2013). Potency monitoring program quarterly report no. 123—Reporting period: 09. 16/2013-12/15/2013.
(5) Gardner, Z., & McGuffin, M. (Eds.). (2013). American Herbal Products Association’s botanical safety handbook. CRC press.
(6) Grotenhermen, F., & Schnelle, M. (2003). Survey on the medical use of cannabis and THC in Germany. Journal of Cannabis Therapeutics, 3(2), 17-40.
(7) Hall, W., & Solowij, N. (1998). Adverse effects of cannabis. The Lancet, 352(9140), 1611-1616.
(8) Ashton, C. H. (1999). Adverse effects of cannabis and cannabinoids. British Journal of anaesthesia, 83(4), 637-649.
(9) Accademies of Sciences, Engineering and Medicine. The health effects of cannabis and cannabinoids: the current state of evidence and recommendations for research. National Accademies Press, 2017
(10) Chandra, S., Lata, H., Khan, I. A., & ElSohly, M. A. (2013). The Role of Biotechnology in Cannabissativa Propagation for the Production of Phytocannabinoids. In Biotechnology for Medicinal Plants (pp. 123-148). Springer, Berlin, Heidelberg.
(11) Pistone, G., Zagà, V., Amram, D. L., & Cammarata, L. M. Cannabis e tabacco: una co-dipendenza epocale. (2018) Tabaccologia 1:26-37.
CADUCEO

Caduceo(gr. dor. καρύκκειον, att. κηρύκειον, da κῆρυξ "araldo"; lat. caducĕus e caducĕum; fr. caducée; sp. caduceo; ted. Schlangenstab, Caduceus; ingl. caduceus)
Il caduceo è una verga recante verso l'estremità due serpenti simmetricamente intrecciati, e al termine due ali spiegate; nell'antichità greco-romana attributo di araldi e messaggeri, specialmente di Ermete.
Il caducèo, si sa, simbolo della Medicina, è rappresentato da un serpente attorcigliato a un bastone. Ma perché mai proprio il serpente?
La prima idea risale alla medicina mesopotamica, dove il caduceo (sachan) era portato da Mingischdiza, figlio di Misagu “signore dei medici”. Quel serpente, secondo la leggenda, aveva mangiato la pianta del vivere eterno, perdendo immediatamente la pelle e riacquistando il proprio aspetto giovanile: era quindi simbolo di rigenerazione e di guarigione da ogni male.
Dalla medicina greca il serpente venne poi “adottato” (avvolto al bastone di Esculapio) anche per un’altra ragione: poiché vive nelle viscere della terra, conosce tutte le virtù delle radici e delle piante medicinali, ed è quindi emblema del sapere medico.
Ma essendo anche velenoso, il serpente riveste il duplice significato di veleno e di virtù terapeutica. Non per altro in greco pharmakòn significa non soltanto medicamento, ma anche sostanza venefica.
Bonsack James Albert
James Albert Bonsack (9 ottobre 1859 – 1º giugno 1924) è stato un inventore statunitense, noto per aver realizzato nel 1880 la prima macchina automatica per l'arrotolamento e la produzione di sigarette.
Nel XIX secolo, ad una ampia diffusione delle sigarette faceva ostacolo la difficoltà di produzione (tutte le sigarette erano confezionate a mano) e, quindi, il loro costo assai elevato: una buona operaia confezionava in otto ore di lavoro non più di 1.000-1.200 pezzi. I
Nel 1875, una ditta statunitense del settore tabacchicolo, la Allen & Cinter, mette in palio un premio di 75.000 dollari per una macchina capace di soppiantare il confezionamento a mano (qualche macchina c’era già, ma imitava il modo di lavorare umano). La rivoluzione arriva cinque anni dopo, quando il 4 settembre 1880 l’idea di James A. Bonsack di una macchina per arrotolare la sigaretta diventa realtà con la presentazione del brevetto con una capacità produttiva di 120.000 sigarette in dieci ore, soppiantando il confezionamento manuale delle sigarettaie. La stessa produzione prima era garantita manualmente dal lavoro di 40 sigarettaie per 12 ore e ½. Ovviamente il dato fa sorridere se confrontato all’attuale produzione di sigarette che si aggira tra le 8.000 e le 14.000 al minuto.
Uno storico nel 1884, riferendosi alla macchina di Bonsack, affermava: "Non ci sono molte macchine al mondo che siano più complicate o che lavorano in modo più mirabile", ma al contempo pensava che avrebbe causato stenti nella società, privando molte persone del lavoro (ciononostante la manifattura di James B. Duke di New York nel 1886 utilizzava quindici macchine di Bonsack, ed impiegava 750 lavoratori).


Bupropione
Principio attivo usato per curare la depressione, agisce sulle stesse aree del cervello coinvolte nella dipendenza da nicotina, riducendo i sintomi di astinenza. E’ controindicato nei fumatori che hanno problemi di cuore, diabete, anoressia, epilessia.
Nicotina (Sindrome da astinenza)
Definizione. La sindrome d'astinenza da nicotina comprende una serie di manifestazioni cliniche che possono insorgere in un soggetto fumatore in seguito alla riduzione o alla sospensione del consumo di tabacco o dell'uso di sigarette elettroniche, che contengono liquidi a base di nicotina
Criteri diagnostici. I criteri diagnostici per la sindrome da astinenza da nicotina, prevedono la presenza, entro 24 ore dalla cessazione o dalla riduzione del fumo, di almeno quattro dei seguenti sintomi:
- umore depresso o disforico
- insonnia
- irritabilità, frustrazione o rabbia
- stato ansioso
- difficoltà di concentrazione
- irrequietezza
- bradicardia
- aumento di appetito o peso
Tali sintomi devono presentarsi dopo numerose settimane di utilizzo del tabacco e devono influire in modo da causare uno stress clinicamente significativo o influire negativamente sulla vita sociale e lavorativa. Inoltre si deve escludere che tali sintomi siano dovuti ad altri disordini mentali.
Fisiopatologia. Viene spesso proposto che gli effetti positivi di rinforzo della nicotina siano il meccanismo chiave per l'inizio del mantenimento del disturbo da uso del tabacco (TUD). Tuttavia, un crescente corpo di letteratura sostiene anche l'importanza del rinforzo negativo anche nel TUD.
Il rinforzo positivo riflette la capacità intrinsecamente gratificante e gli effetti piacevoli che aumentano la probabilità di una continua auto-somministrazione,e rinforzo negativo come effetto della nicotina sull'alleviamento dello stato affettivo spiacevole indotto da deficit cognitivi e altri sintomi negativi associati all'astinenza da nicotina (Fig. 1). Una ragione principale citata spesso dai fumatori per continuare a fumare è quella di"rimanere concentrati", e questa esperienza soggettiva è probabilmente dovuta alla difficoltà di concentrazione, ridotta attenzione e ridotta memoria di lavoro, che sono le conseguenze principali dell'astinenza dal fumo di tabacco. Alte prevalenze di fumatori si osservano tra gli individui con disturbi psichiatrici tra cui schizofrenia, disturbo bipolare, depressione maggiore, disturbo da deficit di attenzione e iperattività (ADHD) e disturbi da uso di sostanze in comorbidità(SUD),perché questi disturbi psichiatrici sono spesso associati con vari disturbi cognitivi,come ad esempio deficit di attenzione, memoria di lavoro e deficit della capacità di inibizione di uno stimolo (impulsività). Le proprietà di potenziamento cognitivo della nicotina possono essere fattori particolarmente importanti dell'inizio e del mantenimento del consumo di tabacco in questa popolazione in comorbidità. Prove crescenti suggeriscono che gli effetti di potenziamento cognitivo della nicotina possono anche contribuire alla difficoltà di smettere di fumare, specialmente negli individui con disturbi psichiatrici. Sono stati compiuti progressi significativi nella comprensione dei meccanismi neurobiologici alla base di questi effetti, compreso una migliore conoscenza del ruolo del recettore nicotinico dell'acetilcolina (nAChR) nella funzione cognitiva e nel rinforzo, la localizzazione delle regioni del cervello che mediano gli effetti della nicotina sulla funzione cognitiva e il ruolo di sottotipi specifici di nAChR nel miglioramento cognitivo, in particolare α7 e α4β2 nAChR che rappresentano bersagli vitali per il trattamento farmacologico dei deficit cognitivi nei disturbi neuropsichiatrici, nonché TUD [1].
Figura 1: modello bivalente del rinforzo della nicotina
In questo modello bivalente, gli effetti comportamentali rilevanti della nicotina sono guidati sia dal rinforzo negativo che da quello positivo, attraverso gli effetti della nicotina sui recettori nAChR α4 β2 e α7. Gli effetti cognitivi della nicotina nella corteccia prefrontale provvedono ai rinforzi negativi, e gli effetti della nicotina sul circuito della gratificazione nel nucleo accumbens provvedono al rinforzo positivo. DA= dopamina, VTA = Area Tegmentale Ventrale, nAChR = recettori nicotinici dell’acetilcolina. (Valentine, G., & Sofuoglu, M. (2018)

La nicotina fumata entra nella circolazione arteriosa e si sposta rapidamente dai polmoni al cervello, dove si lega ai recettori colinergici nicotinici (canali ionici legati al ligando che normalmente legano l'acetilcolina). Il legame della nicotina all'interfaccia tra due subunità del recettore apre il canale, consentendo così l'ingresso del sodio o calcio. L'ingresso di questi cationi nella cellula attiva ulteriormente i canali voltaggio-dipendente del calcio consentendo l'ingresso di più calcio. Una delle conseguenze dell'ingresso del calcio nel neurone è il rilascio di neurotrasmettitori. La stimolazione dei recettori colinergici nicotinici rilascia quindi una varietà di neurotrasmettitori nel cervello. Uno di loro, la dopamina, segnala la presenza di un’ occasione per l’esperienza di piacere ed è fondamentale per l’effetto di rinforzo positivo (effetti che promuovono l'auto-somministrazione) sia di nicotina e di altre droghe d'abuso, sia anche per impulsi naturali efficaci come il mangiare. Sperimentalmente, lesioni indotte nel rilascio da parte dei neuroni specifici di dopamina impediscono l'auto-somministrazione di nicotina nei ratti. La nicotina rilascia dopamina nell’area mesolimbica, nello striato e nella corteccia frontale. I neuroni dopaminergici nell’ Area Tegmentale Ventrale del mesencefalo e nella shell del Nucleo Accumbens sono fondamentali per la ricompensa indotta dalla droga (entrambe le regioni hanno un ruolo nella percezione del piacere legata alla ricompensa) (vedi Figura 2). La nicotina aumenta anche il rilascio di glutammato, che facilita il rilascio di dopamina, e di acido γ-amminobutirrico (GABA), che la inibisce. Con un’esposizione a lungo termine alla nicotina, alcuni recettori colinergici nicotinici si desensibilizzano, mentre altri rimangono sensibilizzati. Di conseguenza, il tono inibitorio mediato dal GABA si riduce, mentre l'eccitazione mediata dal glutammato si mantiene, aumentando così l'eccitazione dei neuroni dopaminergici e migliorando la reattività alla nicotina. La nicotina abbassa la soglia per la ricompensa, un effetto che può durare per più di 30 giorni. Aumenta anche l'attività nella corteccia prefrontale, nel talamo e al livello del sistema visivo, riflettendo un’attivazione dei circuiti cerebrali dei gangli cortico-basali e del talamo (parte della rete di ricompensa) della dopamina nello striato. Altri neurotrasmettitori che possono essere coinvolti nella dipendenza da nicotina sono le ipocretine, i neuropeptidi prodotti nell'ipotalamo laterale che regola gli effetti stimolatori della nicotina sui centri di ricompensa nel cervello e modula l'auto-somministrazione di nicotina nei roditori.
Neuroadattamento
L’esposizione ripetuta alla nicotina porta al neuroadattamento (tolleranza) di alcuni degli effetti della nicotina. Man mano che si sviluppa il neuroadattamento, il numero dei siti di legame sui recettori colinergici nicotinici nel cervello aumentano, probabilmente in risposta alla desensibilizzazione mediata dalla nicotina di recettori. La desensibilizzazione, indotta dalla chiusura dei ligandi e dall’ insensibilità del recettore, svolge un ruolo nella tolleranza e nella dipendenza:
i sintomi di desiderio e astinenza iniziano nei fumatori quando i recettori colinergici nicotinici α4 β2 desensibilizzati diventano reattivi durante i periodi di astinenza, come durante il sonno della notte. Con la ripresa del fumare, la nicotina si lega a questi recettori ed allevia il desiderio e l'astinenza.
Per i fumatori quotidiani, tipicamente, la quantità di sigarette fumate si mantiene costante e corrisponde alla quasi completa saturazione - e quindi desensibilizzazione – dei recettori colinergici nicotinici α4 β2*. Pertanto, probabilmente, i fumatori tentano di evitare i sintomi di astinenza quando permane uno stato di desensibilizzazione dei recettori. Il mantenimento di sufficienti livelli plasmatici di nicotina per prevenire i sintomi di astinenza, è garantito anche dagli effetti gratificanti dei rinforzi condizionati associati al fumo, come il gusto e la sensazione del fumo che transita nelle prime vie respiratoria con l’inalazione.
L'astinenza da nicotina provoca ansia e stress ed entrambi sono potenti incentivi per fumare di nuovo. L'affetto negativo che caratterizza la risposta alla sospensione della nicotina probabilmente risulta in parte da una cascata di eventi che coinvolgono l’aumento dei livelli del fattore di rilascio della corticotropina extraipotalamica (CRF) ed aumento del legame ai recettori di CRF del fattore di rilascio della corticotropina 1 (CRF1) nel cervello, attivando così il sistema recettore CRF-CRF1, che media le risposte dello stress [2].

Figura 2. Ruolo della dopamina mesolimbica nell’attività della nicotina
La nicotina attiva i recettori α4 β2* nell’Area Tegmentale Ventrale, che porta al rilascio della dopamina nel shell del Nucleo Accumbens (Benowitz NL. 2010)
Bibliografia
1) Valentine, G., & Sofuoglu, M. (2018). Cognitive effects of nicotine: recent progress. Current neuropharmacology, 16(4), 403-414.
2) Benowitz, N. L. (2010). Nicotine addiction. New England Journal of Medicine, 362(24), 2295-2303.
Smoking Cessation (benefici)
Smettere i fumare, a qualsiasi età, porta sempre ad un miglioramento, piccolo o grande che sia, delle condizioni generali di salute con benefici pressoché immediati e benefici a medio e lungo termine sulle patologie oncologiche, respiratorie e cardiovascolari.
Il recente Report del Surgeon General sulla cessazione del fumo di tabacco pubblicato nel 2020 [1], evidenzia i benefici alla salute derivanti dalla Smoking Cessation sul cancro di diversi organi ed apparati, sulle malattie cardiovascolari (CVD), sulle malattie croniche delle vie respiratore, e sulla salute riproduttiva.
Benefici generali respiratori e cardiovascolari
EFFETTI IMMEDIATI
Entro 20 minuti dall’ultima sigaretta accesa, la pressione arteriosa, la frequenza cardiaca e la temperatura degli arti inf. si normalizzano. Dopo 10 ore i livelli di CO e O2 tornano normali. Dopo pochi giorni, si riduce la dispnea da sforzo nell’asma e nelle bronco pneumopatie croniche ostruttive (BPCO).
EFFETTI A MEDIO TERMINE
Dopo un anno di astinenza dal fumo di tabacco, il rischio di patologie cardiovascolari si dimezza. Dopo cinque anni il rischio per il cancro del cavo orale, dell’esofago e della vescica si riduce del 50%, e il rischio ictus cerebrale scende al livello dei non fumatori.
EFFETTI A LUNGO TERMINE
Dopo dieci anni, il rischio del cancro polmonare correlato al fumo di tabacco scende del 40-50%. Dopo quindici anni, il rischio di patologie cardiovascolari da fumo diventa uguale a quello dei non fumatori
Particolarmente interessanti sono i benefici della smoking cessation sull'apparato respiratorio, come dimostrato dalla storica ricerca di Fletcher e Peto [2] che condussero uno studio prospettico epidemiologico sugli stadi precoci dello sviluppo della malattia polmonare cronica ostruttiva (COPD) su lavoratori Londinesi. I risultati mostrarono che il volume espiratorio forzato in un secondo (FEV1) si riduce gradualmente nel corso di una vita, ma nella maggioranza dei non fumatori ed in molti fumatori un’ostruzione significativa non compare mai. In persone suscettibili, tuttavia, fumare causa alterazioni in senso ostruttivo parzialmente irreversibili. Se un fumatore suscettibile smette di fumare sebbene non ripristinerà la sua funzione polmonare, la media della perdita ulteriore di FEV1 cambierà in normale con un recupero funzionale respiratorio che si tradurrà in un miglioramento delle condizioni respiratorie. In conclusione lo studio dimostra che più precocemente si inizia a smettere di fumare maggiore è il miglioramento clinic e funzionale respiratorio.
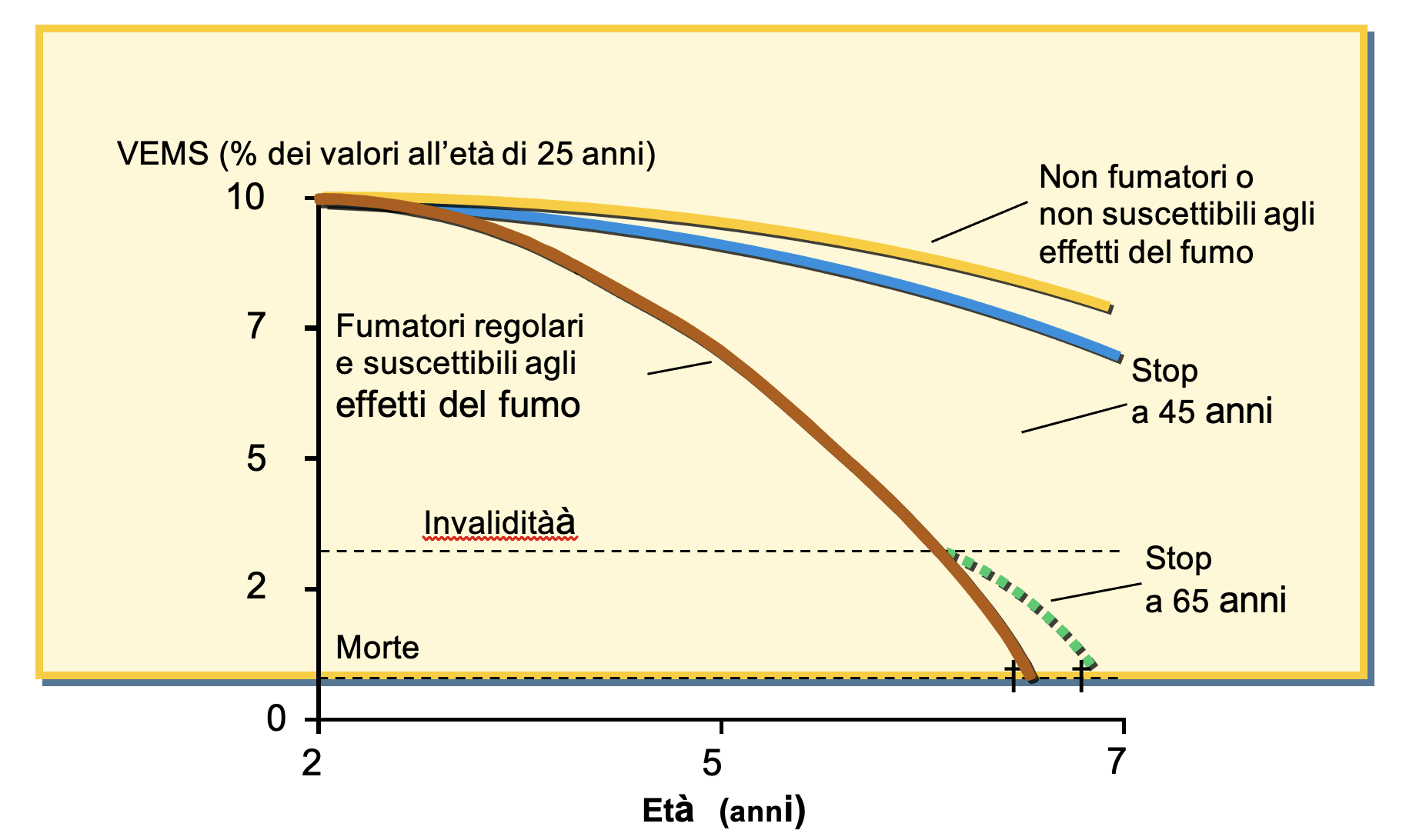
relazione tra età FEV1 e fumo di tabacco
Bibliografia
- S. Department of Health and Human Services. Smoking Cessation. A Report of the Surgeon General. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, Office on Smoking and Health, 2020
- Fletcher C, Peto R, The natural history of chronic airflow obstruction Br Med J, 1977; 1: 1645-1648
Pagina 8 di 12






















